
化学方程式:CH2=CH2+Br2=CH2Br-CH2Br ,条件是高温高压。乙烯和溴水、液溴都可以反应,乙烯和溴单质反应为烯烃的加成反应。加成反应发生在有双键或三键(不饱和键)的物质中。反应进行后,重键打开,原来重键两端的原子各连接上一个新的基团。加成反应一般是两分子反应生成一分子,相当于无机化学的化合反应。而乙烯两个碳原子之间以双键连接,可发生加成反应。扩展资料:乙烯常温下极易被氧化剂氧化。如将乙烯通入酸性高锰酸钾溶液,溶液的紫色褪去,乙烯被氧化为二氧化碳,由此可用鉴别乙烯。易燃烧,并放出热量,燃烧时火焰明亮,并产生黑烟。在一定条件下,乙烯分子中不饱和的碳碳双键中的一个键会断裂,分子里的碳原子能互相形成很长的键且相对分子质量很大(几万到几十万)的化合物,叫做聚乙烯。由相对分子质量较小的化合物(单体)相互结合成相对分子质量很大的化合物的反应,叫做聚合反应。这种聚合反应是由一种或多种不饱和化合物(单体)通过不饱和键相互加成而聚合成高分子化合物的反应,所以又属于加成反应。

是常见的亚硫酸盐,无色、单斜晶体或粉末。对眼睛、皮肤、粘膜有刺激作用,可污染水源。受高热分解产生有毒的硫化物烟气。工业上主要用于制亚硫酸纤维素酯、硫代硫酸钠、有机化学药品、漂白织物等, 还用作还原剂、防腐剂、去氯剂等。物理性质外观与性状:白色、单斜晶体或粉末。CAS:7757-83-7熔点(℃):150(失水分解)相对密度(水=1):2.63分子式:Na2SO3(·7H2O)分子量:126.04(252.04)溶解性:易溶于水(67.8 g/100 ml(七水,18 °C),不溶于乙醇等。化学性质亚硫酸钠在空气中易风化并氧化为硫酸钠。在150℃时失去结晶水。再热则熔化为硫化钠与硫酸钠的混合物。无水物的密度2.633。比水合物氧化缓慢得多,在干燥空气中无变化。受热分解而生成硫化钠和硫酸钠,与强酸接触分解成相应的盐类而放出二氧化硫。亚硫酸钠还原性极强,可以还原铜离子为亚铜离子(亚硫酸根可以和亚铜离子生成配合物而稳定),也可以还原磷钨酸等弱氧化剂。亚硫酸钠及其氢盐在实验室可以用于清除醚类物质的过氧化物(加入少量水,微热搅拌反应后分液,醚层用生石灰干燥,用于一些要求不高的反应)。可与硫化氢归中。

焦炉气,又称焦炉煤气。是指用几种烟煤配制成炼焦用煤,在炼焦炉中经过高温干馏后,在产出焦炭和焦油产品的同时所产生的一种可燃性气体,是炼焦工业的副产品。焦炉气是混合物,其产率和组成因炼焦用煤质量和焦化过程条件不同而有所差别,一般每吨干煤可生产焦炉气300~350m3(标准状态)。其主要成分为氢气(55%~60%)和甲烷(23%~27%),另外还含有少量的一氧化碳(5%~8%)、C2以上不饱和烃(2%~4%)、二氧化碳(1.5%~3%)、氧气(0.3%~0.8%))、氮气(3%~7%)。其中氢气、甲烷、一氧化碳、C2以上不饱和烃为可燃组分,二氧化碳、氮气、氧气为不可燃组分。焦炉气属于中热值气,其热值为每标准立方米17~19MJ,适合用做高温工业炉的燃料和城市煤气。焦炉气含氢气量高,分离后用于合成氨,其它成分如甲烷和乙烯可用做有机合成原料。焦炉气为有毒和易爆性气体,空气中的爆炸极限为6%~30%。扩展资料;焦炉煤气的特点:1、焦炉煤气发热值高16720—18810kJ/m3,可燃成分较高(约90%左右);2、焦炉煤气为无色有臭味的气体;3、焦炉煤气因为含有CO和少量的H2S而有毒;4、焦炉煤气含氢多,燃烧速度快,火焰较短;5、焦炉煤气如果净化不好,将含有较多的焦油和萘,就会堵塞管道和管件,给调火工作带来困难;6、着火的温度为600~650℃。

化学中的红色固体有:红色固体单质:铜或红磷;化合物:氧化铁。铜是呈紫红色光泽的金属,密度8.92克/立方厘米。熔点1083.4±0.2℃,沸点2567℃。有很好的延展性。导热和导电性能较好。铜是不太活泼的重金属,在常温下不与干燥空气中的氧气化合,加热时能产生黑色的氧化铜。红磷是巨型共价分子,无定型结构。外观与性状:紫红色无定形粉末,无臭,具有金属光泽,在暗处不发磷光,无臭。不溶于水也不溶于二硫化碳以及乙醇等有机溶剂。氧化铁易溶于强酸,中强酸,外观为红棕色粉末。其红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中,可作为催化剂,玻璃、宝石、金属的抛光剂,可用作炼铁原料。固体的颜色1、红色固体:铜,氧化铁2、绿色固体:碱式碳酸铜3、蓝色固体:氢氧化铜,硫酸铜晶体4、紫黑色固体:高锰酸钾5、淡黄色固体:硫磺6、无色固体:冰,干冰,金刚石7、银白色固体:银,铁,镁,铝,汞等金属8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭)9、红褐色固体:氢氧化铁10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁

HCHO+H2-催化剂→CH3OH,氢气和C=O的加成,H-H断开,C=O断开一个键,然后两个H原子分别加到C和O上。甲醛甲醛,无色有刺激性气体,化学式HCHO或CH₂O,分子量30.03,又称蚁醛。对人眼、鼻等有刺激作用。气体相对密度1.067(空气=1),液体密度0.815g/cm³(-20℃)。熔点-92℃,沸点-19.5℃。易溶于水和乙醇。水溶液的浓度最高可达55%,一般是35%-40%,通常为37%,称做甲醛水,俗称福尔马林(formalin)。 具有还原性,尤其在碱性溶液中,还原能力更强。能燃烧,蒸气与空气形成爆炸性混合物,爆炸极限7%-73%(体积),燃点约300℃。可由甲醇在银、铜等金属催化下脱氢或氧化制得,也可从烃类的氧化产物中分出。可作为酚醛树脂、脲醛树脂、维纶、乌洛托品、季戊四醇、染料、农药和消毒剂等的原料。工业甲醛溶液一般含37%甲醛和15%甲醇,作阻聚剂,沸点101℃。氢气常温常压下,氢气是一种极易燃烧,无色透明、无臭无味且难溶于水的气体。氢气是世界上已知的密度最小的气体,氢气的密度只有空气的1/14,即氢气在1标准大气压和0℃,氢气的密度为0.089g/L。所以氢气可作为飞艇、氢气球的填充气体(由于氢气具有可燃性,安全性不高,飞艇现多用氦气填充)。氢气是相对分子质量最小的物质,主要用作还原剂。工业上一般从天然气或水煤气制氢气,而不采用高耗能的电解水的方法。制得的氢气大量用于石化行业的裂化反应和生产氨气。氢气分子可以进入许多金属的晶格中,造成“氢脆”现象,使得氢气的存储罐和管道需要使用特殊材料(如蒙耐尔合金),设计也更加复杂。

氮气,化学式为N2,通常状况下是一种无色无味的气体,而且一般氮气比空气密度小。氮气占大气总量的78.08%(体积分数),是空气的主要成份之一。在标准大气压下,氮气冷却至-195.8℃时,变成无色的液体,冷却至-209.8℃时,液态氮变成雪状的固体。化学性质氮气的化学性质不活泼,常温下很难跟其他物质发生反应,所以常被用来制作防腐剂。但在高温、高能量条件下可与某些物质发生化学变化,用来制取对人类有用的新物质。物理性质1.无色无味的气体;2.不易溶于水;3.在标准条件下,密度为1.251g/L,略低于空气。

化学性质是物质在化学变化中表现出来的性质。元素的化学性质由什么决定是由最外层电子数决定,元素种类由质子数决定。最外层电子数与金属元素的性质密切相关,金属元素最外层电子数一般小于4,在化学反应中易失去电子;非金属元素最外层电子数一般大于或等于4,易得到电子。化学性质“主要”是由原子结构决定的,其实也与其它因素有关。比如配制成溶液的电解质参与反应时就要快很多。而影响物理性质的主要因素则至少包括两个方面:一是原子结构,二是宏观物质的内部结构。

元素周期表是学好化学的基础,化学前20化学元素是氢,氦,锂,铍,硼,碳,氮,氧,氟,氖,钠,镁,铝,硅,磷,硫,氯,氩,钾,钙。那么,20个化学元素顺口溜是什么呢?20个化学元素顺口溜(1)H,He,Li,Be,B(氢,氦,锂,铍,硼):亲爱李皮彭;(2)C,N,O,F,Ne(碳,氮,氧,氟,氖):坦荡养福来;(3)Na,Mg,Al,Si,P(钠,镁,铝,硅,磷):那美女桂林;(4)S,Cl,Ar,K,Ca(硫,氯,氩,钾,钙):牛肉要加钙;化学元素顺口溜有不同版本,可以挑一个自己喜欢的进行记忆。

首先将纸分为三个部分,然后写出标题。画出纸的形状,再画上化学器具和元素。然后开始勾边,擦去草稿,最后进行上色就完成了。

(1)推荐常见病害使用农药。 防治霜霉病可选用58%甲霜灵锰锌可湿性粉剂500倍液或69%安克锰锌可湿性粉剂600-800倍液或72%克霜氰可湿性粉剂500-700倍液或72.2%普力克水剂800倍液等喷雾。 防治炭疽病、黑斑病可选用70%甲基托布津500-700倍液或80%炭疽福美可湿性粉剂800倍液等喷雾。 防治软腐病等细菌性病害可选用72%农用链霉素可溶性粉剂4000倍液或77%可杀得可湿性微粒粉剂400倍液、新植霉素4000倍液喷雾。 (2)推荐常见虫害使用农药。 防治菜蚜可用500%抗蚜威可湿性粉剂2000-3000倍液或25%快杀灵1000倍液等喷雾。 防治菜青虫、小菜蛾也可选用菊酯类农药等,应限用菊酯类杀虫剂。 防治甜菜夜蛾可用52.25%农地乐乳油1000-1500倍液喷雾,且在傍晚施药效果最佳。
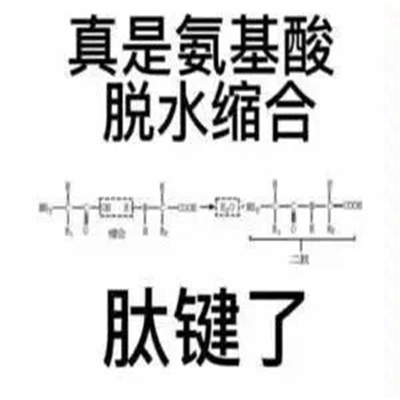
这组很有文化的怼人表情怎么能错过了,给我们带来很多快乐跟文化的趣味表情,是不是没想到化学反应还能这么玩。

初中化学方程式大全及现象 一、 氧气的性质: 1.1. 单质与氧气的反应:(化合反应) 1、镁在空气中燃烧:2Mg + O2 点燃 2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光 2、铁在氧气中燃烧:3Fe + 2O2点燃 Fe3O4现象:剧烈燃烧、火星四射、生成黑色的固体 3、铜在空气中受热:2Cu + O2 △ 2CuO 4、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3 5、氢气中空气中燃烧:2H2 + O2 点燃 2H2O 现象:淡蓝色的火焰 6、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5 现象:生成白烟 7、硫粉在空气中燃烧: S + O2 点燃 SO2 现象:空气中是淡蓝色的火焰;纯氧中是蓝紫色的火焰;同时生 成有刺激性气味的气体。 8、碳在氧气中充分燃烧:C + O2 点燃 CO2 现象:生成能够让澄清石灰水浑浊的气体 9、碳在氧气中不充分燃烧:2C + O2 点燃 2CO 现象:生成可燃烧气体 1.2. 化合物与氧气的反应: 10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2 11、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 12、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 1.3. 氧气的来源: 13、玻义耳研究空气的成分实验:2HgO △ 2Hg+ O2 ↑ 现象:生成银白色的液体金属 14、加热高锰酸钾:2KMnO4 △ K2MnO4 + MnO2 + O2↑ 现象:生成能让带火星的木条复燃的气体 15、加热氯酸钾:2KClO3 MnO2 2KCl + 3O2↑现象:同上 16、过氧化氢分解:H2O2 MnO2 2H2O + O2 ↑现象:溶液里冒出大量的气泡 二、自然界中的水: 17、电解水:2H2O 通电 2H2↑+ O2 ↑ 18、生石灰溶于水:CaO + H2O = Ca(OH)2 现象:放出大量的热 19、二氧化碳可溶于水: H2O + CO2 = H2CO3 三、质量守恒定律: 20、镁在空气中燃烧:2Mg + O2 点燃 2MgO 21、铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu 22、氢气还原氧化铜:H2 + CuO △ Cu + H2O 现象:由黑色的固体变成红色的,同时有水珠生成 23、氢气还原氧化铁:2Fe2O3 + 3H2高温 2Fe + 3H2O现象:有水珠生成,固体颜色由红色变成银白色 24、镁还原氧化铜:Mg + CuO △ Cu + MgO 四、碳和碳的氧化物: 4.1. 碳的化学性质 25、碳在氧气中充分燃烧:C + O2 点燃 CO2 26、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑ 现象:固体由黑色变成红色并减少,同时有能使纯净石灰水变浑 浊的气体生成 27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑ 现象:固体由红色渐变银白色,同时黑色固体减少,有使纯净的 石灰水变浑浊的气体生成 28、甲烷的形成:3C + 2H2O = CH4+2CO现象:生成的混和气体叫水煤气,都是可以燃烧的气体 4.2. 煤炉中发生的三个反应:(几个化合反应) 29、煤炉的底层:C + O2 点燃 CO2 30、煤炉的中层:CO2 + C 高温 2CO 现象:黑色固体逐渐减少 31、煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2 4.3. 二氧化碳的制法与性质: 32、大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 33、碳酸不稳定而分解:H2CO3 = H2O + CO2↑ 34、二氧化碳可溶于水: H2O + CO2 = H2CO3 35、高温煅烧石灰石:CaCO3 高温 CaO + CO2↑ 现象:有能使纯净石灰水变浑浊的气体生成 36、石灰水与二氧化碳反应:Ca(OH)2 + CO2 = CaCO3 ↓+ H2O 现象:生成白色的沉淀,用于检验二氧化碳 4.4. 一氧化碳的性质: 37、一氧化碳还原氧化铜:CO+ CuO △ Cu + CO2 现象:固体由黑色逐渐变成红色,同时有能使纯净的石灰水变浑 浊的气体生成 38、一氧化碳还原氧化铁:Fe2O3 + 3CO高温 2Fe+3CO2 现象:固体由黑色逐渐变成银白色,同时有能使纯净石灰水变浑 浊的气体生成 39、一氧化碳的可燃性:2CO + O2 点燃 2CO2 40、碳酸钠与稀盐酸反应(灭火器的原理): Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 五、燃料及其利用: 41、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O 42、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O 43、氢气中空气中燃烧:2H2 + O2 点燃 2H2O 六、金属 6.1. 金属与氧气反应: 44、镁在空气中燃烧:2Mg + O2 点燃 2MgO 45、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4 现象:铁剧烈燃烧,火星四射,生成黑色的固体 46、铜在空气中受热:2Cu + O2 △ 2CuO 47、铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3 6.2. 金属单质 + 酸 = 盐 + 氢气 (置换反应) 48、锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑ 现象:有可燃烧的气体生成 49、铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑ 现象:变成浅绿色的溶液,同时放出气体 备注:Fe在置换反应中只能生成亚铁,即Fe2+ 50、镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑ 现象:有可燃烧的气体生成 51、铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑ 现象:有可燃烧的气体生成 52、锌和稀盐酸Zn + 2HCl = ZnCl2 + H2↑ 现象:有可燃烧的气体生成 53、铁和稀盐酸Fe + 2HCl = FeCl2 + H2↑ 现象:溶液变成浅绿色,同时放出气体 54、镁和稀盐酸Mg+ 2HCl = MgCl2 + H2↑ 现象:有可燃烧的气体生成 55、铝和稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑ 现象:有可燃烧的气体生成 6.3. 金属单质 + 盐(溶液) = 新金属 + 新盐 56、铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu 现象:铁溶解生成红色金属 57、锌和硫酸铜溶液反应:Zn + CuSO4 = ZnSO4 + Cu 现象:有红色金属生成 58、铜和硝酸银溶液反应:Cu + Ag(NO3)2 = Cu(NO3)2 + Ag现象:红色的铜逐渐溶解,同时有银白色的金属生成 6.4. 金属铁的冶炼原理: 59、3CO+ 2Fe2O3 高温 4Fe + 3CO2↑ 现象:固体由红色逐渐变成银白色,同时有能使纯净石灰水变浑浊的气体生成 七、酸、碱、盐 A、酸的化学性质 7.1. 酸 + 氧化物 = 盐 + 水 60、氧化铁和稀盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 现象:红色固体逐渐溶解,形成黄色的溶液 61、氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 现象:红色固体溶解,生成黄色溶液 62、氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2 + H2O 现象:黑色固体溶解,生成黄绿色的溶液 63、氧化铜和稀硫酸反应:CuO + H2SO4 = CuSO4 + H2O 现象:黑色固体溶解,生成蓝色溶液 7.2. 酸 + 碱 = 盐 + 水(中和反应) 64、盐酸和烧碱起反应:HCl + NaOH = NaCl +H2O 现象:不明显 65、盐酸和氢氧化钙(氢氧化钾)反应:2HCl + Ca(OH)2 = CaCl2 + 2H2O HCl + KOH = KCl + H2O 66、盐酸和氢氧化铁反应:Fe(OH)3 + 3HCl = FeCl3 + 3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液 67、盐酸和氢氧化铜反应:Cu(OH)2 + 2HCl = CuCl2 + 2H2O 现象:蓝色沉淀溶解,形成黄绿色的溶液 68、氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 = AlCl3 + 3H2O 69、硫酸和烧碱反应:H2SO4 + 2NaOH = Na2SO4 + 2H2O 现象:不明显 70、硫酸和氢氧化铜反应:Cu(OH)2+H2SO4 = CuSO4 ↓+ 2H2O现象:蓝色沉淀溶解,生成蓝色溶液 7.3. 酸 + 盐 = 另一种酸 + 另一种盐 71、大理石与稀盐酸反应:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑现象:白色固体溶解,生成能使纯净石灰水变浑浊的气体 72、硝酸银与稀盐酸反应:HCl+AgNO3 = AgCl↓+HNO3现象:有白色沉淀生成,这个反应用于检验氯离子 73、碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 74、碳酸氢钠与稀盐酸反应:NaHCO3 + HCl = NaCl + H2O + CO2↑ 75、硫酸和氯化钡溶液反应:H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子 B、碱的化学性质 7.4. 碱 + 非金属氧化物 = 盐 + 水 76、苛性钠暴露在空气中变质:2NaOH + CO2 = Na2CO3 + H2O 现象:不明显 77、苛性钠吸收二氧化硫气体:2NaOH + SO2 = Na2SO3 + H2O 78、苛性钠吸收三氧化硫气体:2NaOH + SO3 = Na2SO4 + H2O 79、消石灰放在空气中变质:Ca(OH)2 + CO2 = CaCO3 ↓+ H2O 现象:生成白色的沉淀 80、消石灰吸收二氧化硫:Ca(OH)2 + SO2 = CaSO3 ↓+ H2O 7.4. 碱 + 酸 = 盐 + 水(中和反应,方程式见上) 7.5. 碱 + 盐 = 另一种碱 + 另一种盐 81、氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 = CaCO3↓+ 2NaOH C、盐的化学性质 7.6. 盐(溶液) + 金属单质 = 另一种金属 + 另一种盐 82、 铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu 7.7. 盐 + 酸 = 另一种酸 + 另一种盐(见上) 7.8. 盐 + 碱 = 另一种碱 + 另一种盐(见上) 7.9. 盐 + 盐 —– 两种新盐 83、氯化钠和硝酸银溶液:NaCl + AgNO3 = AgCl↓ + NaNO3现象:有白色沉淀生成,这个反应可用于检验氯离子 84、硫酸钠和氯化钡:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl 八、补充化学方程式: 85、二氧化碳溶解于水:CO2 + H2O = H2CO3 86、生石灰溶于水:CaO + H2O = Ca(OH)2 87、氧化钠溶于水:Na2O + H2O = 2NaOH 88、三氧化硫溶于水:SO3 + H2O = H2SO4 89、硫酸铜晶体受热分解:CuSO4·5H2O △ CuSO4 + 5H2O 现象:固体由蓝色变为白色 90、无水硫酸铜作干燥剂:CuSO4 + 5H2O = CuSO4·5H2O 以下仅供参考: 91、CaCO3 + CO2 + H2O = Ca(HCO3)2 现象:白色固体逐渐溶解 92、Ca(HCO3) △ CaCO3↓ + CO2↑ + H2O 现象:生成白色的沉淀,同时有使纯净的石灰水变浑的气体生成 93、Fe3O4 + 4CO = 3Fe + 4CO2 现象:固体由黑色变成银白色,同时有能使纯净石灰水变浑浊的 气体生成 94、3Ag + 4HNO3(稀) = 3AgNO3 + NO↑ + 2H2O 现象:银逐渐溶解,生成气体遇空气变棕色 95、Ag + 2HNO3(浓) = AgNO3 + NO2↑ + H2O 现象:银逐渐溶解,生成棕色气体 96、Cu + 2H2SO4(浓) = CuSO4 + SO2↑ + 2H2O 现象:铜逐渐溶解,生成有刺激性气味的气体 97、2FeCl3 + Fe = 3FeCl2 现象:铁粉逐渐溶解,溶液由黄色变成浅绿色 98、2Na2O2(过氧化钠) + 2H2O = 4NaOH + O2↑ 现象:有能使带火星的木条复燃的气体生成 归纳总结: 一、两个置换反应规律 1、酸 + 金属 = 盐 + 氢气 反应条件: ①酸不能用强氧化性酸,如硝酸、浓硫酸,(常用稀硫酸、盐酸) ②金属必须位于氢以前(常用Mg、Al、Zn、Fe) Mg + 2HCl = MgCl2 + H2↑ Mg + H2SO4 = MgSO4 + H2↑ 2Al + 6 HCl = 2AlCl3 + 3H2↑ 2Al + 3H2SO4 = 2Al2(SO4)3 + 3H2↑ Zn + 2HCl = ZnCl2 + H2↑ Zn + 2H2SO4 = ZnSO4 + H2↑ Fe + 2HCl = FeCl2 + H2↑ Fe + H2SO4 = FeSO4 + H2↑ 2、盐+金属 = 新盐+新金属 反应条件: ①盐(反应物)必须溶于水 ②金属单质(反应物)比盐中金属活泼,不用钾、钙、钠 Fe + CuSO4 = FeSO4 + Cu 2Al + 3CuSO4 = Al2(SO4)3 + 3Cu Zn + CuSO4 = ZnSO4 + Cu Cu + 2AgNO3 = Cu(NO3)2 + 2AgCu + Hg(NO3)2 = Cu(NO3)2 + Hg 二、三个分解反应规律 1、酸(含氧酸)= 非金属氧化物+水 H2CO3 = H2O + CO2↑ 2、碱(难溶性)= 金属氧化物+水 Cu(OH)2 = CuO + H2O 2Fe(OH)3 = Fe2O3 + 3H2O 3、碳酸盐(难溶性)= 金属氧化物+二氧化碳 CaCO3 = CaO + CO2↑ 三、 四个化合反应规律 1、金属 + 氧气 = 金属氧化物 2Mg + O2 = 2MgO3Fe + 2O2 = Fe3O42Cu + O2 = 2CuO 2、金属氧化物 + 水 = 碱(可溶性) CaO + H2O = Ca(OH)2 Na2O + H2O = 2NaOH 3、非金属 + 氧气 = 非金属氧化物 S + O2 = SO2 4P + 5O2 = 2P2O5 C + O2 = CO2 (碳充分燃烧) 2C + O2 = 2CO (碳不充分燃烧)2H2 + O2 = 2H2O 4、非金属氧化物 + 水 = 酸 CO2 + H2O = H2CO3 SO3 + O2 = H2SO4 SO2 + O2 = H2SO3(亚硫酸) 四、五个复分解反应规律 1、酸 + 碱 = 盐 + 水 Cu(OH)2 + 2HCl = CuCl2 + H2O Al(OH)3 + 3HCl = AlCl3 + 3H2O Cu(OH)2 + H2SO4 = CuSO4 + 2H2O Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O 2、酸 + 盐 = 新酸 + 新盐 反应条件:符合复分解反应发生的条件(实际反应条件很复杂) CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ AgNO3 + HCl = AgCl↓ + HNO3 Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ H2SO4 + BaCl2 = 2HCl + BaSO4↓ H2SO4 + Ba(NO3)2 = 2HNO3 + BaSO4 ↓ 3、盐 + 碱 = 新盐 + 新碱 反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉) CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓ CuSO4 + Ba(OH)2 = Cu(OH)2↓ + BaSO4 ↓ 4、盐+盐 = 新盐+新盐 反应条件:反应物都溶于水,生成物至少有一种不溶(前溶后沉) NaCl + AgNO3 = NaNO3 + AgCl↓ Na2SO4 + BaCl2 = 2NaCl + BaSO4 ↓ Na2SO4+Ba(NO3)2 = 2NaNO3+BaSO4 ↓ 5、酸 + 金属氧化物 = 盐 + 水 Fe2O3 + 6HCl = 2FeCl3 + 3H2O Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O CuO + 2HCl = CuCl2 + H2O CuO + H2SO4 = CuSO4 + H2O MgO + 2HNO3 = Mg(NO3)2 + H2O 五、其它反应 1、碱 + 非金属氧化物 = 盐 + 水(不属于四种化学反应基本类型)注:非金属氧化物溶于水后形成相应的酸根 2NaOH + CO2 = Na2CO3 + H2O 2NaOH + SO2 = Na2SO3 + H2O 2NaOH + SO3 = Na2SO4 + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O 2、三种还原剂(H2 、CO、 C 、 O2 )跟氧化物反应 属于置换反应的:H2 + CuO = Cu + H2O CO + CuO = Cu + CO2↑3CO + Fe2O3 = 2Fe + 3CO2↑ C + 2CuO = 2Cu + CO2↑ 属于化合反应的:C + CO2 = 2CO 3、实验室制取三种气体(常用方法) 氧气:2KMnO4 = K2MnO4 + MnO2 + O2↑ 2KClO3 MnO2 2KCl + 3O2↑ 氢气:Zn + 2HCl = ZnCl2 + H2↑ Zn + 2H2SO4 = ZnSO4 + H2↑ 二氧化碳:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 4、盐分解(基本上有气体产生) Cu2(OH) + 2CO3 = 2CuO + H2O + CO2↑ CaCO3 = CaO + CO2↑ KMnO4 = K2MnO4 + MnO2 + O2↑ 2KClO3 = 2KCl +3O2↑ 5、三种有机物燃烧 甲烷:CH4 + 2O2 = 2H2O + CO2↑ 乙醇(食用酒精):C2H5OH + 3O2 = 3H2O + 2CO2↑

大家好,今天我们要一起来学习比较抽象的一个知识点:化学反应的方向。 我们都知道在自然界或者是实际的生产、生活当中呢,有一些过程是自发进行的,而且是有一定的方向性的。比如水总是自发的从高处流向低处,而相反,要想水从低处流向高处是不能自发进行的,它需要借助例如抽水机这样的外力啊。回到化学这个话题上,有些反应也是自发进行的,而且是具有方向性的。那么我们今天就要来学习怎样判断化学反应自发进行的方向。 这里需要跟大家介绍一个概念,自发过程指的是在一定条件下不需要借助外力,例如光、电这样的作用就可以自动进行的过程。相反,不会自然发生的,比如需要持续地借助外力才能进行的过程叫做非自发过程。关于这个概念会有两点注意事项。第一点,一定要分清,我们的化学反应是有外部条件的,比如说在一定的条件下,而有些反应是不需要外部条件的,比如酸、碱中和反应,无需任何的反应条件就可以自发地进行,那什么叫做需要持续借助外力的作用呢?例如说电解食盐水,那我们就需要持续地去借助电的作用,才能够让这个反应发生。 在实验的过程中,我们发现大多数的放热反应都是可以自发进行的,所以这里需要提醒大家,并不是说氢气、氧气不需要任何条件就可以生成水。它是需要点燃或者是加热才可以生成水,但它依然是一个可以自发进行,只不过它不需要持续的外力。同时我们通过实验还知道,例如八水合氢氧化钡与氯化胺,没有需要任何的外力条件就可以自发进行。而这个反应是一个吸热的过程,同时碳酸铵分解成碳酸氢氨和氨气,以及五氧化二氮生成二氧化氮和氧气,这些反应虽然都是吸热的,却依然是一个自发的过程,所以我们不能只根据放热或者是吸热来判断化学反应的方向。 除了吸热反应、放热反应这一个条件之外,教材为我们介绍了一个新的概念,也是一个物理量,它叫做熵。比如在密闭的一种条件下,体系从有序的、自发的转变成无序的,这样的倾向我们可以用熵去衡量,就是混乱程度。混乱程度用s去表示,也就是熵低代表很整齐,混乱度很小,而熵高代表很混乱,从熵低变熵高的过程,△S会大于零。 我们会观察到无论是水自发的进行,还是放热反应或吸热反应,这些都是自发的从混乱度小、有序的状态变成混乱度大、无序的状态进行的。 那我们再以一些化学方程式为例来解释熵增的过程。比如这里面方程式展示到的锌是固态、硫酸是液态、硫酸锌是液态、氢气是气态、氯酸钾是固态,氯化钾是固态,而氧气是气态。所谓的熵增就是混乱度,它会越来变得越大。但是有些熵减的过程也是自发的,比如乙烯聚合成聚乙烯的过程,虽然混乱度在减小,但是它可以自发的进行。而且屏幕上方展示的这两个方程式虽然也在熵减,但是都是可以自发进行的。 最熟悉的就是氢氧化铁变成氢氧化亚铁的过程,这是一个明显的熵减过程,可是它可以自发地进行。由此我们得到的这样的结论,不能只根据熵增或熵减来判断化学反应进行的方向。 上面的内容总结下来,我们会观察到自发反应的方向除了跟焓变有关,还和熵变有关。但是单独地去看焓变或者是熵变,又不可以作为自发进行的判断依据。教材当中给我们一个资料卡片,自由能和化学反应的方向。其实是要综合考虑体系的焓变和熵变,它也叫做自由能的变化,有兴趣的同学可以仔细的去研读一下大学的内容,或者是以这个资料、卡片为内容进行研究。 以上就是今天的全部内容,如果有疑问可以留言,也欢迎大家积极转发。

初三上学期是我们刚接触化学学科的时候,也是很多同学记忆化学方程式头疼的时候,下来我们就给大家整理一下初三化学上下两册需要记忆的化学方程式如下: 九年级上册需要记忆的方程式1. 碳酸钠与稀盐酸反应(灭火器的原理): Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 2. 铁在氧气中燃烧:3Fe + 2O2= 点燃= Fe3O4 3. 铜在空气中受热:2Cu + O2= 加热= 2CuO 4. 铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3 5. 氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O 6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2= 点燃= 2P2O5 7. 硫粉在空气中燃烧: S + O2 =点燃 =SO2 8. 高温煅烧石灰石(工业制二氧化碳):CaCO3 =高温= CaO + CO2↑ 9. 石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2 + CO2 === CaCO3 ↓+ H2O 10. 一氧化碳还原氧化铁:3CO+ Fe2O3 =高温= 2Fe + 3CO2 11. 焦炭还原氧化铁:3C+ 2Fe2O3 =高温 =4Fe + 3CO2↑ 12. 甲烷在空气中燃烧:CH4 + 2O2 =点燃= CO2 + 2H2O 13.酒精在空气中燃烧:C2H5OH + 3O2 =点燃= 2CO2 + 3H2O 14. 拉瓦锡研究空气的成分实验: 2HgO =加热= 2Hg+ O2 ↑ 15. 加热高锰酸钾:2KMnO4 =加热= K2MnO4 + MnO2 + O2↑(实验室制氧气原理1) 16.过氧化氢加入二氧化锰:2H2O2= MnO2 =2H2O+ O2 ↑(实验室制氧气原理2) 17. 氯酸钾与二氧化锰加热: 2KClO3 =MnO2 (加热) =2KCl+ 3O2 ↑(原理3) 18.水在直流电的作用下分解(研究水的组成实验) :2H2O =通电= 2H2↑+ O2 ↑ 19.生石灰溶于水:CaO + H2O == Ca(OH)2 20.二氧化碳可溶于水: H2O + CO2==H2CO3 21.氢气还原氧化铜:H2 + CuO =加热 =Cu + H2O 22. 镁还原氧化铜:Mg + CuO=加热= Cu + MgO 23. 一氧化碳还原氧化铜:CO+ CuO =加热 =Cu + CO2 24.木炭还原氧化铜:C+ 2CuO =高温= 2Cu + CO2↑ 25.镁在空气中燃烧:2Mg + O2 =点燃= 2MgO 26.铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu 煤炉中发生的四个反应:(几个化合反应) 26.煤炉的底层:C + O2 =点燃 =CO2 (碳在氧气中充分燃烧) 27.煤炉的中层:CO2 + C =高温= 2CO 2C + O2 =点燃= 2CO(碳在氧气中不充分燃烧) 28.煤炉的上部蓝色火焰的产生:2CO + O2 =点燃= 2CO2 29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ 30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑ 31.二氧化碳可溶于水: H2O + CO2== H2CO3 九年级下册所有化学方程式(大家关键掌握置换复分解反应规律) (1)金属单质 + 酸 ——– 盐 + 氢气 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑ 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑ 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑ 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑ 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑ 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑ 镁和稀盐酸Mg+ 2HCl == MgCl2+ H2↑ 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑ (2)金属单质 + 盐(溶液) ——- 新金属 + 新盐 铁和硫酸铜溶液反应:Fe + CuSO4 ==FeSO4 + Cu(湿法冶金) 酸、碱、盐 1、酸的化学性质 (1)酸 + 金属 ——– 盐 + 氢气(见上) (2)酸 + 金属氧化物——– 盐 + 水 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O (3)酸 + 碱 ——– 盐 + 水(中和反应) 盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2 O 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2 O 硫酸和烧碱反应:H2 SO4 + 2NaOH == Na2 SO4 + 2H2 O (4)酸 + 盐 ——– 另一种酸 + 另一种盐 大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2 O + CO2↑ 碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2 O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ 硫酸和氯化钡溶液反应:H2 SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质 (1) 碱 + 非金属氧化物 ——– 盐 + 水 苛性钠暴露在空气中变质:2NaOH + CO2 == Na2 CO3 + H2 O 苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2 SO3 + H2 O 苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2 SO4 + H2 O 消石灰放在空气中变质:Ca(OH) 2 + CO2 == CaCO3 ↓+ H2 O 消石灰吸收二氧化硫:Ca(OH) 2 + SO2 == CaSO3 ↓+ H2 O (2)碱 + 酸——– 盐 + 水(中和反应,方程式见上) (3)碱 + 盐 ——– 另一种碱 + 另一种盐 氢氧化钙与碳酸钠:Ca(OH) 2 + Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质 (1)盐(溶液)+金属单质——- 另一种金属+另一种盐 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu (2)盐 + 酸——– 另一种酸 + 另一种盐 碳酸钠与稀盐酸反应: Na2 CO3 + 2HCl == 2NaCl + H2 O + CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑ (3)盐 + 碱 ——– 另一种碱 + 另一种盐 氢氧化钙与碳酸钠:Ca(OH) 2 + Na2 CO3 == CaCO3↓+ 2NaOH (4)盐 + 盐 —– 两种新盐 氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3 硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl 以上就是给大家整理的九年级全册分为上下两册的需要记忆的所有的化学方程式 有需求获取专业化学老师讲解的可以购买以下的专栏 大家好,由于教育资源的不平均,我们可邦教育的老师在头条上组建了一个免费圈子【初中学习圈】。 主要用于整理和归纳一些初中学习资料,分享初中学习心得 加入后 1.每日会固定分享一份初中学习资料 2.如果你有什么资料需要,请评论,我们会尽快整理。适合人群: 想帮助提高孩子学习的家长、初高中学生 更新频率:每天一更 欢迎各位同学加入。 (此处已添加圈子卡片,请到今日头条客户端查看)
氯酸钾制取氧气的化学式为:2KClO3=(MnO2△)=2KCl+3O2↑。氯酸钾===(等号上面是二氧化锰,下面是△)氯化钾+氧气。此反应属于一种物质生成两种或两种以上其他物质的分解反应,在此反应中,氧元素变成氧单质,化合价发生变化。实验室氯酸钾制取氧气的方法1、高锰酸钾加热制取氧气:该化学反应方程式是2KMnO4(加热)=K2MnO4+MnO2+O2;2、氯酸钾和二氧化锰加热制取氧气:该化学反应方程式是2KClO3(MnO2,加热)=2KCl+3O2;3、双氧水在二氧化锰的作用制取氧气:该化学反应方程式是:2H2O2(MnO2)=2H2O+O2;4、过氧化钠和二氧化碳反应制取氧气:该化学反应方程式是Na2O2+2CO2=O2+2NaCO3;5、电解水制取氧气:该化学方程式是2H2O(通电)=2H2+O2;6、过氧化钠和水反应制取氧气:该化学反应方程式是2Na2O2+2H2O=O2+4NaOH。氯酸钾的性质1、物理性质无色或白色不含结晶水的结晶体,或者白色粉末。味咸而凉,有毒,内服2-3g就可能引起中毒而死亡。微溶于乙醇,溶于水和碱溶液。但在水中的溶解度比氯酸钠小,并且随着温度升高而急剧上升。每100g水中的溶解度在20℃时是7.1g,在100℃时是56.4g。不易潮解。2、化学性质氯酸钾是强氧化剂。如有催化剂等存在,在较低温度下就能分解而强烈放出氧气。这里特别需要说明的是,氯酸钾分解放氧是放热反应。在酸性溶液中有强氧化作用。与碳、磷及有机物或可燃物混合受到撞击时,都易发生燃烧和爆炸。氯酸钾的用途有哪些氯酸钾是一种敏感度很高的炸响剂,有时候甚至会在日光照射下自爆。遇浓硫酸会爆炸。可与用二氧化锰做催化剂,在加热条件下反应生成氧气,由离子构成。氯酸钾可用作氧化剂;测定锰、硫、镍、铜和硫化铁;炸药原料;制药;实验室制氧气。氯酸钾用途较广,用于炸药、烟花、鞭炮、高级安全火柴,医药、摄影药剂、分析试剂、氧化剂及火箭、导弹推进剂等。在同系列的推进剂中,含氯酸钾的推进剂比含氯酸铵的推进剂燃烧的快,燃烧能够进行的最低压力较高,燃速指数很高。

感谢邀请生石灰的化学式是什么! 生石灰,主要成分是氧化钙,其消毒的原理就是生石灰遇水变成强碱—氢氧化钙,生石灰作为一种强碱性消毒剂,成本低廉,容易购买,而且冬季消毒效果也很显著,在鸡场广泛使用。 但是很多养鸡网友也会遇到这样的问题,因为使用不当会造成消毒效果差,甚至造成鸡群的伤害,所以养鸡网友掌握正确的石灰石消毒方法是如此重要! 一)石灰石的使用方法 1)生石灰消毒原理是与水混合,反应生成氢氧化钙,强碱性,发挥消毒的作用,因此使用的时候是不能单独把生石灰撒在地面上就可以了,这样是错误的消毒方式,生石灰这样用完全没效果。 鸡场正确使用生石灰的方法是: 鸡场生石灰消毒操作中 先在鸡舍地面洒适量的清水,然后把适量粉状的生石灰均匀洒在鸡舍各个地方,这时生石灰与刚才洒的清水会发生化学反应,生成的氢氧化钙,强碱性,是具有杀菌消毒的作用的。 2)除了将生石灰撒在地面上消毒,对环境消毒,还可以将生石灰配成10%~20%石灰乳将其涂抹在鸡舍墙壁或者地面,各个角落,缝隙,这样不仅装饰了鸡舍,还对鸡舍环境进行了消毒。 二)生石灰使用注意事项 1)生石灰易吸水,吸收空气中的水分发生化学反应,因此购买生石灰一定要在短期内用完,避免因存贮不当造成失效。每次购买生石灰不要买太多,够用就可以了。 2)使用的时候不可以将生石灰和水直接混合再喷洒在鸡舍,鸡场内,这样配完的溶液发生反应,温度高,而且极易与空气中的二氧化碳反应,生成碳酸钙沉淀物,消毒有效成分变少,也是导致消毒失效的重要原因,所以在使用的时候一定要按正确方法操作。 3)使用生石灰消毒的时候,不能与漂白粉,硫酸铜等混合使用,这几种消毒剂混合使用,会大大降低消毒效果!还有生石灰不能与敌百虫一起使用,否则会发生反应,生成敌敌畏有毒物质。 4)使用时避免生石灰中混入杂质,否则在消毒过程中化学反应热量过大可能会引起爆炸等。 生石灰成本低廉,消毒效果好,是养鸡网友一定要掌握的鸡场消毒妙招哦! 鸡病咨询可以关注小龙女的头条号—-养禽一家人,也可以搜索小龙女的公众号—养禽一家人,获取更多养鸡秘诀哦!也欢迎养鸡网友留言讨论鸡病哦! 生石灰和熟石灰的化学式是什么 生石灰和熟石灰的化学式是:CaO、CaCO₃。生石灰的化学式为CaO氧化钙,熟石灰的化学式为Ca(OH)2氢氧化钙,生石灰制熟石灰:CaO+H2O=Ca(OH)2,是化合反应,会放出大量的热。生石灰(CaO)与水反应生成氢氧化钙的过程,称为石灰的熟化或消化,与水反应(同时放出大量的热),或吸收潮湿空气中的水分,即成熟石灰。熟石灰是一种白色粉末状固体,强碱性,具有杀菌与防腐能力,对皮肤,织物有腐蚀作用 。氢氧化钙在工业中有广泛的应用。它是常用的建筑材料,也用作杀菌剂和化工原料等。 熟石灰和生石灰的化学式是什么 熟石灰、生石灰分别化学式对应氢氧化钙Ca(OH)₂、氧化钙CaO。熟石灰是氢氧化钙,是一种无机化合物,是一种白色粉末状固体,加入水后,呈上下两层,上层水溶液称作澄清石灰水,下层悬浊液称作石灰乳或石灰浆,上层清液澄清石灰水可以检验二氧化碳,下层浑浊液体石灰乳是一种建筑材料。生石灰又称烧石灰,主要成分为氧化钙,通常制法为将主要成分为碳酸钙的天然岩石,在高温下煅烧,即可分解生成二氧化碳以及氧化钙。凡是以碳酸钙为主要成分的天然岩石,如石灰岩、白垩、白云质石灰岩等,都可用来生产石灰。在沿海地区可以用贝壳作原料,经烧制成壳灰,作生石灰用。